科学家伉俪发现免疫细胞与痛觉感受神经元可调
发布时间:2023-01-04 22:00来源: 未知近期,来自美国康奈尔大学威尔康奈尔医学院博士后夫妇吕梦泽与张雯分别先后在 Nature 与 Cell 上发表论文。
凑巧的是,两篇顶刊论文的正式接收和发布时间都仅差了一个月。从一起攻读博士学位到开展博士后工作,科研之路漫长修远,但他们从未对科研失去热情,互相鼓励,互相帮助,取得了阶段性的研究成果。

 (来源:吕梦泽、张雯)
(来源:吕梦泽、张雯)
其中的一篇论文揭示了在免疫系统对肠道菌群产生免疫耐受的过程中,3 型先天性淋巴细胞(ILC3s,Group 3 Innate Lymphoid Cells)发挥了重要作用;另一篇论文首次报道了一群专职感受疼痛的神经元细胞,伤害感受器(nociceptors),通过调节肠道微生物菌群稳态在抑制肠道炎症保护肠道组织中的关键作用。

3 型天然淋巴细胞促使肠道建立微生物免疫耐受
定植在哺乳动物肠道内的微生物会引起炎性或免疫耐受性 T 细胞反应,但科学家对相关机制知之甚少。为此,研究人员对相关调控机制做了深入的探索。
 (来源:Nature)
(来源:Nature)
今年 9 月,相关论文以《ILC3 选择微生物群特异性调节T细胞在肠道中建立耐受》(ILC3s select microbiota-specific regulatory T cells to establish tolerance in the gut)为题发表于 Nature[1]。
吕梦泽为该论文的第一作者。第一作者是吕梦泽(博士后)和 Hiroaki Suzuki(访问学者),威尔康奈尔医学院。通讯作者是 Gregory Sonnenberg,Associate Professor,威尔康奈尔医学院。
研究人员首先利用单细胞测序分析了健康小鼠肠系膜淋巴结(mLN)中表达 RORγt 的免疫细胞群。
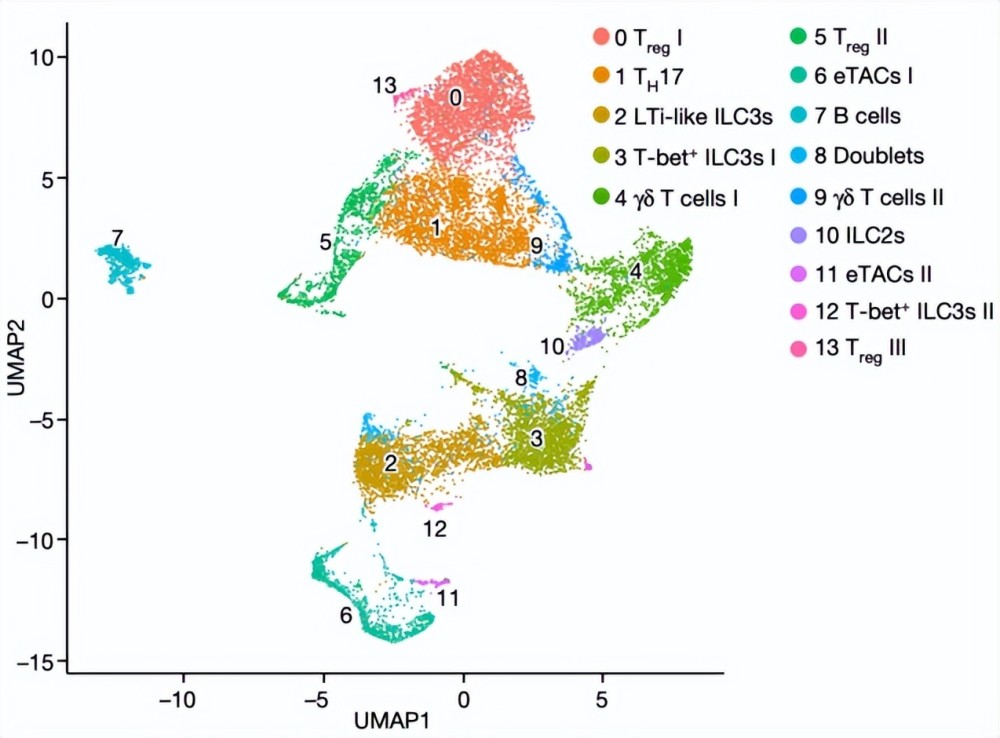 图 | 小鼠 mLN RORγt+ 细胞的 scRNA-Seq 分析(来源:Nature)
图 | 小鼠 mLN RORγt+ 细胞的 scRNA-Seq 分析(来源:Nature)
检验结果表明,其主要包括由淋巴组织诱导物样(LTi-like)ILC3s 为代表的天然免疫细胞和 RORγt+ Tregs 为代表的适应性免疫细胞。
这些细胞通常能介导肠道微生物引起的免疫反应,从而维持肠道和机体处于稳态。
研究者通过免疫荧光实验进一步观察到,ILC3 与RORγt+Treg 在 mLN 的滤泡间区(interfollicular zone)存在共定位,提示了两种细胞之间可能存在相互作用。
进一步的小鼠和体外实验表明,ILC3 可以通过主要组织相容性复合体 II 类(MHCII)以及整合素 αv(Integrin av,ITGAV)来调控微生物抗原特异性的 RORγt+Treg 细胞的分化。
更重要的是,研究者还利用单细胞测序技术和流式细胞术分析了儿童炎症性肠病患者和健康对照者的活组织检查样品和切除样品。
结果表明,ILC3s 能够促进 RORγt+ Tregs 的分化并且这一调节关系在 IBD 病人中出现了失调,这也提示了 ILC3s 调控 RORγt+ Tregs 及其在维持人体肠道健康稳态中的重要作用。
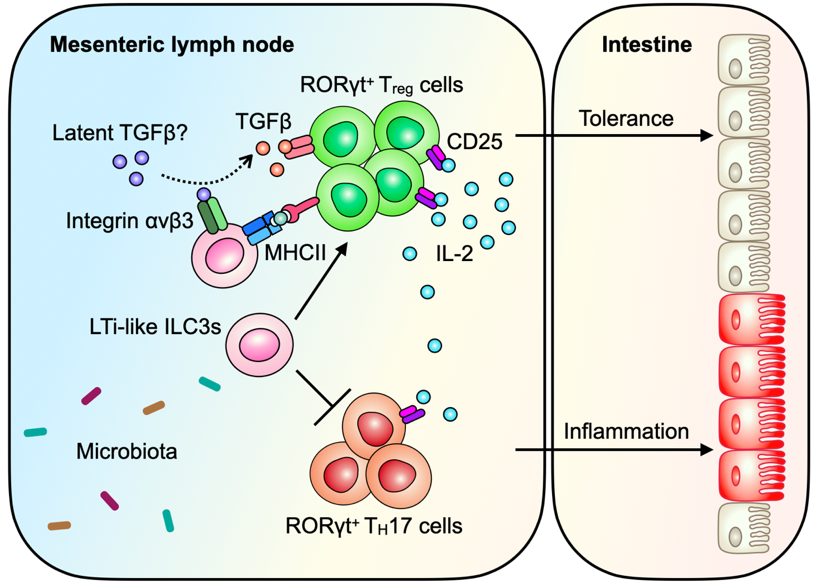 图 | ILC3s 通过 MHCII和ITGAV 调控微生物特异性 RORγt+Tregs(来源:Nature)
图 | ILC3s 通过 MHCII和ITGAV 调控微生物特异性 RORγt+Tregs(来源:Nature)
综上所述,这项研究挑战了传统观念上的主要由树突状细胞(DCs)负责诱导并促进调节性 T 细胞分化的理论,提出了全新的通路即 ILC3s 可以通过 MHCII 和 ITGAV 来调控肠道微生物特异性 RORγt+ Tregs,并在肠道中建立正常的微生物免疫耐受,揭示了 ILC3s 在小鼠和人体中维持肠道稳态的又一重要作用。
这项研究不仅是对免疫学教科书的理论补充,更是对肠道疾病患者的临床治疗提供了重要的理论参考和新的思路。

TRPV1+伤害感受器调节肠道菌群抑肠炎
人类慢性疾病的出现往往伴随着相应组织器官的疼痛,这被看做早期疾病出现的预警信号,对于肠道炎症性疾病尤其如此。
然而,科学家对痛觉神经元能否对肠道菌群以及肠道炎症的调控作用仍不清楚。
今年 10 月,张雯及其所在团队在 Cell 期刊上发表论文,题目为 Gut-innervating nociceptors regulate the intestinal microbiota to promote tissue protection [2]。
他们首次发现,发现肠道中感受疼痛的神经—TRPV1+伤害感受器与肠道菌群互作,在限制肠道炎症、保护肠组织方面发挥关键作用。
第一作者张雯,博士后,威尔康奈尔医学院。通讯作者 David Artis,Professor, 威尔康奈尔医学院。
 (来源:Cell)
(来源:Cell)
机体内绝大多数的炎症反应伴随着局部组织的红肿热痛及机能障碍。机体通过一群外周神经系统的感受神经(Nociceptor 痛觉感受器/伤害感受器)来感受外界不良刺激介导的生理性疼痛。
那么这一群痛觉感受器在调控肠道炎症以及炎症性肠病中具有什么功能呢?为了研究这一科学问题,研究人员运用神经生物学和化学遗传学(Chemogenetics)的方法,通过特异性调控 TRPV1+ nociceptor 的活性和功能,结合小鼠的肠炎损伤模型,发现在抑制 Nociceptor 的活性和功能之后,小鼠对肠炎损伤的易感性显著加重。
此外,通过使用一种天然化学物质树脂毒素(Resiniferatoxin/RTX)永久清除 TRPV1+ nociceptor 之后,缺失 Nociceptor 的小鼠同样对肠炎损伤具有更高的易感性。
这些数据说明 TRPV1+ nociceptor 在小鼠肠炎损伤模型中具有关键的组织保护功能。
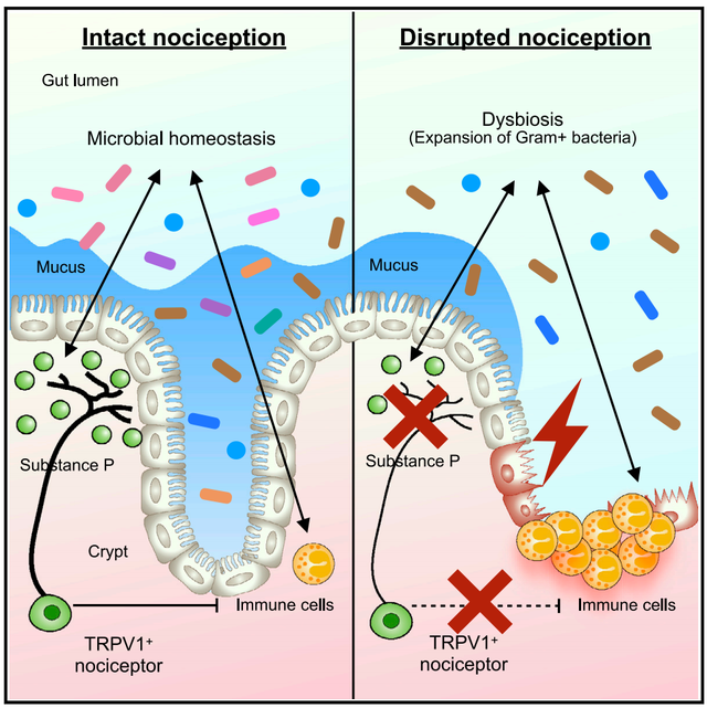
那么,TRPV1+ nociceptor 具体是如何介导这种组织保护功能的呢?研究人员通过一系列免疫学分析和微生物学高通量测序研究,发现缺失 Nociceptor 的小鼠的肠道微生物菌群发生了显著的变化。
通过运用无菌小鼠和含特定菌群的小鼠模型(Gnotobiotic mouse model),研究人员发现如果将缺失 Nociceptor 小鼠的肠道微生物菌群移植到无菌小鼠体内,被移植缺失 Nociceptor 小鼠微生物菌群的受体小鼠也会获得对于肠炎损伤更高的易感性。
通过使用一系列抗生素来特异性清除不同的微生物菌群,研究人员发现革兰氏阳性菌(Gram+)的菌群失调是导致缺失 Nociceptor 小鼠具有更高的肠炎损伤易感性的主要原因之一。
有意思的是,研究人员在梭状芽孢杆菌属 Gram+ Clostridium spp.的单菌群小鼠模型中也看到了和 SPF 小鼠的一样的表型。
这些数据说明 TRPV1+ nociceptor 通过调控特定肠道菌群的稳态来保护肠道组织免受外界损伤诱导的肠炎。
其中,革兰氏阳性菌群以及 Gram+ Clostridium spp.是可能受到这群神经调控的关键靶向菌群。
 (来源:Cell)
(来源:Cell)
综上所述,这项研究首次揭示了 TRPV1+ nociceptor 作为痛觉感受神经元的全新免疫调控功能以及神经--微生物相互作用(neuron-microbiota crosstalk)在肠道免疫和肠道微生物稳态中的关键作用,更是对肠道疾病患者的临床治疗提供了重要的理论参考和新的思路。