《科学》:万年“杀手”如何成功躲避免疫反应
发布时间:2022-10-14 21:00来源: 未知由结核分枝杆菌(Mycobacterium tuberculosis)感染引起的结核病,被称为史上杀人最多的传染病。即便到了21世纪,结核病仍然威胁着全世界。据世界卫生组织报道,2020年全球有近990万新发结核病患者,并有约151万人因结核感染导致死亡。致病的结核菌还潜伏在更多人体内:全世界1/4的人口体内隐藏着活的结核菌,一生中有5%~10%的可能性变成结核病人。
尽管人体的免疫系统可以在抵抗结核菌感染入侵时发挥重要防御作用,但结核病之所以难以消灭,很重要的一个原因是:作为一种古老的细菌杀手,结核菌已经发展出了大量在细胞内生存的策略,能够成功躲避宿主的免疫反应,神不知鬼不觉地推动结核病的发生和发展。可以说,结核菌和宿主之间存在着事关生死的长期博弈。
今日,国际权威学术期刊《科学》发表了一篇来自中国团队的研究论文,揭示了结核分枝杆菌通过抑制细胞焦亡(pyroptosis)逃脱免疫反应的一种新机制。这一发现可以提高人们对结核病发病机制的理解,并且有望为防治结核病提供新的药物靶标及干预策略。中国科学院微生物研究所的刘翠华研究员、汪静项目研究员和北京师范大学的邱小波教授为共同通讯作者。

“焦亡”是一种程序性细胞死亡形式,在细菌侵入后,宿主细胞通过焦亡释放出胞内的一系列炎症介质,引起抗菌反应。焦亡过程的一个特征是炎症小体(inflammasome)剪切和激活下游效应分子GSDMD,使剪切后产生的GSDMD-N聚集在质膜内侧并产生孔洞。既往研究提示,炎症小体-细胞焦亡通路在宿主抵抗病原体感染过程中发挥重要作用。
然而,科学家们此次工作中证实结核菌却能够通过重塑宿主细胞的膜质组成,逃逸这种免疫机制。
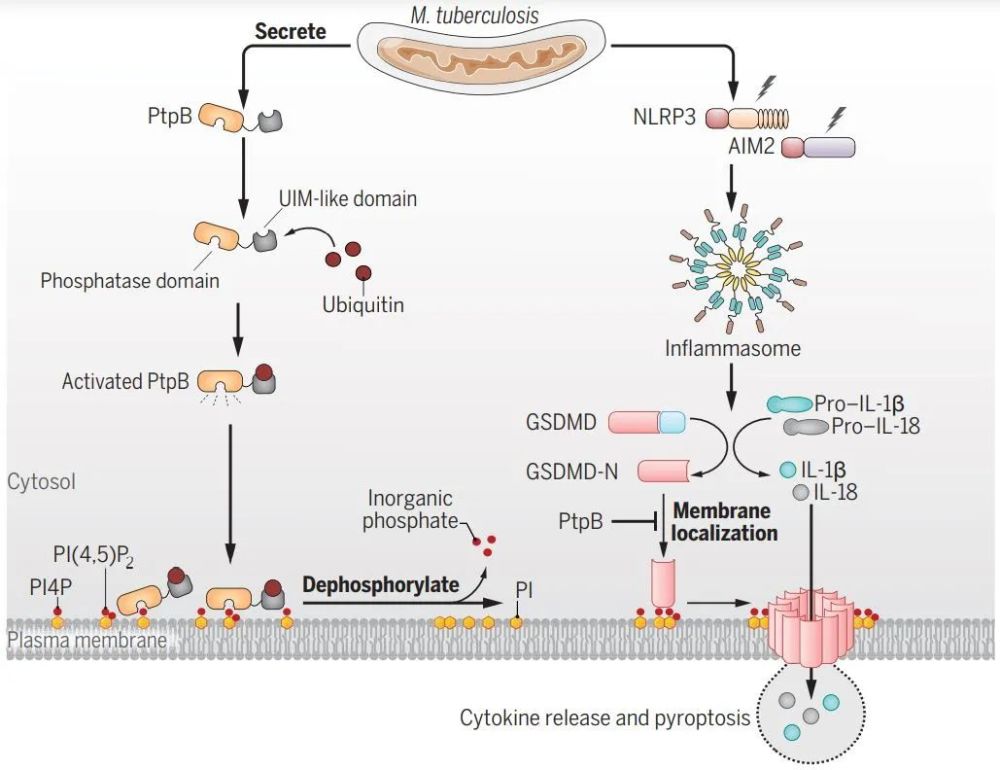
▲研究示意图:结核分枝杆菌通过劫持泛素重塑宿主细胞的膜脂稳态,进而抑制细胞焦亡(图片来源:参考资料[1])
为了鉴定出结核菌调控炎症小体-细胞焦亡通路的关键效应蛋白,研究人员首先对结核菌的整个基因组进行分析,筛选结核菌产生的真核样分泌蛋白。根据研究人员的预测,这类真核样分泌蛋白可以直接针对宿主细胞。
在200多个预测的蛋白中,研究人员鉴定出结核菌在感染期间大量分泌的蛋白——磷酸酶PtpB是宿主炎症小体-细胞焦亡通路的潜在抑制分子。
进一步机制研究表明,PtpB在结核菌感染时可定位至宿主细胞质膜,并依赖其磷酸酶活性作用于质膜上的磷脂酰肌醇-4-单磷酸(PI4P)及磷脂酰肌醇-(4,5)-二磷酸(PI(4,5)P2),从而抑制GSDMD-N在质膜上的聚集并阻止炎症介质IL-1β和IL-18的释放。
研究人员注意到,PtpB虽然在细胞内有显著的去磷酸化PI4P及PI(4,5)P2的功能,但它在细胞外仅表现出有限的脂磷酸酶活性。结构生物学分析表明,PtpB的酶活中心(P-loop)被掩盖在一个盖状的柔性双螺旋结构(lid)内,提示其磷酸酶活性可能受到动态调控。
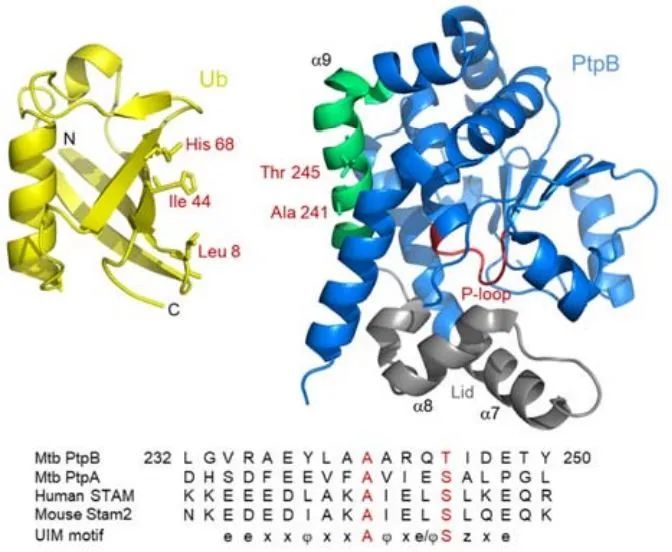
▲PtpB与宿主泛素结合的互作界面(图片来源:参考资料[1])
结合之前的研究工作,刘翠华研究团队推断,PtpB的磷酸酶活性可能受到宿主细胞中特定分子的调控。循着这一线索,研究团队发现,PtpB的磷酸酶活性需要与泛素结合。具体来说,PtpB依赖一个特殊的真核样泛素结合模序(UIM-like),通过疏水相互作用结合宿主泛素并被其激活,进而去磷酸化PI4P和PI(4,5)P2。
随后的小鼠感染实验证明,破坏PtpB的脂磷酸酶活性或泛素结合区域可以显著增强宿主在感染早期依赖GSDMD的保护性免疫反应及清除结核菌的能力,并减轻宿主在感染晚期的病理性免疫损伤。
综合上述结果,研究团队最终揭示了结核菌利用脂磷酸酶PtpB挟持宿主泛素进而抑制细胞焦亡的免疫逃逸机制,从而提供了基于病原-宿主互作界面的结核病治疗新思路和潜在新靶标。
刘翠华课题组的特别研究助理柴琪瑶、客座研究生余珊珊以及博士研究生钟延昭为该论文的并列第一作者,中国科学院微生物研究所的刘翠华研究员、汪静项目研究员和北京师范大学的邱小波教授为共同通讯作者。这项工作得到了国家自然科学基金委、国家重点研发计划、中国科学院战略性先导科技专项(B类)、中国科学院青年创新促进会及中国博士后科学基金会的支持。

