你可能没了解过“二氧化硫”吧
发布时间:2020-03-05 09:30来源: 未知二氧化硫(化学式SO2)是最常见、最简单的硫氧化物。大气主要污染物之一。火山爆发时会喷出该气体,在许多工业过程中也会产生二氧化硫。由于煤和石油通常都含有硫元素,因此燃烧时会生成二氧化硫。当二氧化硫溶于水中,会形成亚硫酸。若把亚硫酸进一步在PM2.5存在的条件下氧化,便会迅速高效生成硫酸(酸雨的主要成分)。这就是对使用这些燃料作为能源的环境效果的担心的原因之一。
2017年10月27日,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,二氧化硫在3类致癌物清单中。

二氧化硫 - 分子结构
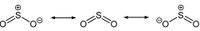
二氧化硫,是一个弯曲的分子,其对称点群为C2v。硫原子的氧化态为+4,形式电荷为0,被5个电子对包围着,因此可以描述为超价分子。从分子轨道理论的观点来看,可以认为这些价电子大部分都参与形成S-O键。
SO2中的S-O键长(143.1pm)要比一氧化硫中的S-O键长(148.1pm)短,而O3中的O-O键长(127.8pm)则比氧气O2中的O-O键长(120.7pm)长。SO2的平均键能(548kJmol?1)要大于SO的平均键能(524kJmol?1),而O3的平均键能(297kJmol?1)则小于O2的平均键能(490kJmol?1)。这些证据使化学家得出结论:二氧化硫中的S-O键的键级至少为2,与臭氧中的O-O键不同,臭氧中的O-O键的键级为1.5。
分子结构与极性:V形分子,极性分子。
二氧化硫 - 物理性质
二氧化硫是无色有刺激性气味的气体。溶于丙酮、乙醇、甲酸等多种有机溶剂,溶于水(0℃时溶解度22.8g/l00ml,90℃时溶解度0.58g/100ml)。水溶液呈酸性。在硫酸溶液中的溶解度以硫酸浓度为85%时为最小。液态时为良好的溶剂。2000℃以上发生热分解,也可通过电场放电、紫外线或X射线辐射等分解。
二氧化硫 - 化学性质
酸性氧化物
SO2是酸性氧化物,具有酸性氧化物的通性。可以与水作用得到二氧化硫水溶液,即“亚硫酸”(中强酸),但真正的亚硫酸分子从未在溶液中观测到。
S02+H2OH2SO3
与碱反应形成亚硫酸盐和亚硫酸氢盐。以与氢氧化钠的反应为例,产物是Na2SO3 还是NaHSO3,取决于二者的用量关系。
SO2+2NaOH——>Na2SO3+H2O或
SO2+NaOH——>Na2SO3
与碱性氧化物反应生成盐。
氧化还原反应
SO2中的硫元素的化合价为+4价,为中间价态,既可升高,也可下降。所以SO2既有氧化性,又有还原性,但以还原性为主。
SO2的还原性较强,可被多种氧化剂(如O2、Cl2、Br2、HNO3、KMnO4等)氧化。
SO2+CL2——>SO2CL2
2SO2+O22SO3(该反应为可逆反应,条件为加热和催化剂:V2O5 /Pt/Cr2O3)
SO2也有一定的氧化性,如:
SO2+2H2S——>3S+2H2O
工业上可以用此反应制造高纯度硫磺。
二氧化硫 - 生产方法
工业制备
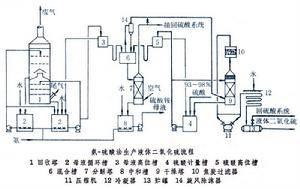
制取二氧化硫的方法有:焚烧硫磺;焙烧硫铁矿或有色金属硫化矿;焚烧含硫化氢的气体;煅烧石膏或磷石膏;加热分解废硫酸或硫酸亚铁;以及从燃烧含硫燃料的烟道气中回收(见硫酸原料气)。
生产液体二氧化硫时通常先制得纯二氧化硫气体,然后经压缩或冷冻将其液化。重要的工业生产方法有:
①哈涅希-希洛特法。此法始创于1884年,以水作吸收剂,吸收二氧化硫后的溶液以蒸汽解吸,解吸气经冷凝、干燥后液化。现在发展了加压水吸收法。
②氨-硫酸法。此法常用于一次转化的接触法硫酸厂中尾气二氧化硫的回收 。以氨水为原始吸收剂,用硫酸分解吸收液,制得纯二氧化硫气体。
③溶液吸收法。以无机或有机溶液吸收低浓度二氧化硫气体,然后将吸收液加热再生,制得纯二氧化硫。主要的吸收剂有碳酸钠、柠檬酸钠、碱式硫酸铝、有机胺类等的溶液。
④直接冷凝法。以冷冻法从含二氧化硫的气体中将其部分冷凝分离,直接制得液体二氧化硫,未冷凝的二氧化硫返回硫酸生产系统。
⑤三氧化硫-硫磺法。使液体硫磺与三氧化硫在反应器中进行反应,制得纯二氧化硫气体。
实验室制备
实验室通常用亚硫酸钠与浓硫酸反应制取二氧化硫
Na2SO3+H2SO4=Na2SO4+SO2(g)+H2O
